Изменения реологических свойств крови у больных с метаболическим синдромом
Метаболический синдром (МС) – комплекс метаболических нарушений и сердечно–сосудистых заболеваний, патогенетически взаимосвязанных через инсулинорезистентность (ИР) и включающих нарушение толерантности к глюкозе (НТГ), сахарный диабет (СД), артериальную гипертензию (АГ), сочетающихся с абдоминальным ожирением и атерогенной дислипидемией (повышение триглициридов – ТГ, липопротеидов низкой плотности – ЛПНП, снижение липопротеидов высокой плотности – ЛПВП) [1,4,5,12,14,15].
СД, как компонент МС, по своей распространенности занимает место непосредственно после сердечно–сосудистых и онкологических заболеваний, а по прогнозам экспертов ВОЗ, его распространенность к 2010 году достигнет 215 млн человек [1,6,8,15].
СД опасен своими осложнениями, так как поражение сосудов при диабете является причиной развития АГ, ИМ, инсульта головного мозга, почечной недостаточности, потери зрения и ампутации конечностей.
С позиции классической биореологии кровь можно рассматривать как суспензию, состоящую из форменных элементов в коллоидном растворе электролитов, белков и липидов. Микроциркуляторный отдел сосудистой системы является тем местом, где проявляется наибольшее сопротивление кровотоку, что связано с архитектоникой сосудистого русла и реологическим поведением компонентов крови [3,6,10].
Реология крови (от греческого слова rhe’os – течение, поток) – текучесть крови, определяемая совокупностью функционального состояния форменных элементов крови (подвижность, деформируемость, агрегационная активность эритроцитов, лейкоцитов и тромбоцитов), вязкости крови (концентрация белков и липидов), осмолярности крови (концентрация глюкозы). Ключевая роль в формировании реологических параметров крови принадлежит форменным элементам крови, прежде всего эритроцитам, которые составляют 98% от общего объема форменных элементов крови [2,6,11].
Прогрессирование любого заболевания сопровождается функуционально–структурными изменениями тех или иных форменных элементов крови. Особый интерес вызывают изменения эритроцитов, мембраны которых являются моделью молекулярной организации плазматических мембран. От структурной организации мембран красных кровяных клеток во многом зависят их агрегационная активность и деформируемость, являющиеся важнейшими компонентами в микроциркуляции [3,11,13].
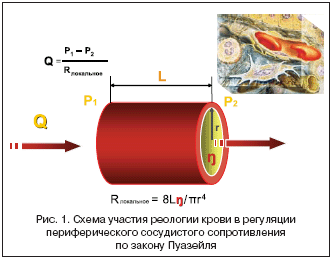
Вязкость крови является одной из интегральных характеристик микроциркуляции, существенно влияющих на гемодинамические параметры. Долевое участие вязкости крови в механизмах регуляции АД и органной перфузии нашло отражение в законе Пуазейля:
МОоргана= (Рарт – Рвен)/ Rлок, где Rлок.= 8Lh / pr4,
где L – длина сосуда, h – вязкость крови, r – диаметр сосуда (рис. 1).
Большое количество клинических работ, посвященных гемореологии крови при СД и МС, выявили снижение параметров, характеризующих деформируемость эритроцитов. У больных СД пониженная способность эритроцитов к деформации и их повышенная вязкость являются следствием увеличения количества гликированного гемоглобина (HbА1с). Высказано предположение, что связанное с этим затруднение кровообращения в капиллярах и изменение давления в них стимулирует утолщение базальной мембраны, ведет к снижению коэффициента диффузионной доставки кислорода к тканям, то есть аномальные эритроциты играют триггерную роль в развитии диабетической ангиопатии [2,3,6,11,13].
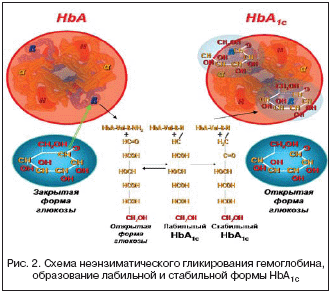
HbА1с – это гликированный гемоглобин, в котором молекулы глюкозы конденсируются с b–концевым валином b–цепи молекулы HbА. Более 90% гемоглобина здорового человека представлено HbАО, имеющим 2?– и 2b–полипептидные цепи. Гликированные формы гемоглобина составляют в совокупности ?HbА = HbА1а + HbА1в + HbА1с. Не все промежуточные лабильные соединения глюкозы с HbА превращаются в стабильные кетоновые формы, так как их концентрация зависит от длительности контакта эритроцита и количества глюкозы в крови в конкретный момент (рис. 2). Сначала эта связь глюкозы с HbА «слабая» (т.е. обратимая), затем при стабильно–повышенном уровне сахара в крови эта связь становится «прочной» и сохраняется до тех пор, пока эритроциты не разрушатся в селезенке. В среднем продолжительность жизни эритроцитов составляет 120 дней, поэтому уровень связанного с сахаром гемоглобина (HbА1с) отражает состояние обмена веществ у больного СД за период 3–4 месяца. Процент связанного с молекулой глюкозы Hb дает представление о степени повышения сахара крови; он тем выше, чем длительнее и больше уровень сахара крови и наоборот [1,4,8,9].
Сегодня постулировано – высокое содержание сахара в крови является одной из основных причин развития неблагоприятных последствий диабета, так называемых поздних осложнений (микро– и макроангиопатии). Поэтому высокие показатели HbА1с являются маркером возможного развития поздних осложнений СД [1,4,7,15]
HbА1с, по данным различных авторов, составляет 4–6% общего количества Hb в крови здоровых людей, тогда как у больных СД уровень HbА1с в 2–3 раза выше.
Нормальный эритроцит в обычных условиях имеет двояковогнутую форму диска, за счет чего площадь его поверхности больше на 20% в сравнении со сферой того же объема.
Нормальные эритроциты способны значительно деформироваться при прохождении через капилляры, при этом не меняя своего объема и площади поверхности, что поддерживает процессы диффузии газов на высоком уровне на протяжении всего микроциркуляторного русла различных органов. Показано, что при высокой деформируемости эритроцитов происходит максимальный перенос кислорода в клетки, а при ухудшении деформируемости (повышение жесткости) – поступление кислорода в клетки резко снижается, тканевое рО2 падает [2,3,13].
Деформируемость является важнейшим свойством эритроцитов, обусловливающим их способность выполнять транспортную функцию. Это способность эритроцитов изменять свою форму при постоянном объеме и площади поверхности позволяет им приспосабливаться к условиям кровотока в системе микроциркуляции. Деформируемость эритроцитов обусловлена такими факторами, как внутренняя вязкость (концентрация внутриклеточного гемоглобина), клеточная геометрия (поддержание формы двояковогнутого диска, объем, отношение поверхности к объему), и свойствами мембраны, которые обеспечивают форму и эластичность эритроцитов.
Деформируемость во многом зависит от степени сжимаемости липидного бислоя и постоянством его взаимосвязи с белковыми структурами клеточной мембраны.
Эластические и вязкостные свойства мембраны эритроцитов определяются состоянием и взаимодействием белков цитоскелета, интегральных белков, оптимальным содержанием АТФ, ионов Са2+, Mg2+ и концентрацией гемоглобина, которые обусловливают внутреннюю текучесть эритроцита. К факторам, повышающим жесткость мембран эритроцитов, относятся: образование стойких соединений гемоглобина с глюкозой, повышение концентрации в них холестерина и увеличение концентрации свободного Са2+ и АТФ в эритроците.
Ухудшение деформируемости эритроцитов имеет место при изменении липидного спектра мембран, и прежде всего при нарушении соотношения холестерин/фосфолипиды, а также при наличии продуктов повреждения мембраны в результате перекисного окисления липидов (ПОЛ). Продукты ПОЛ оказывают дестабилизирующее воздействие на структурно–функциональное состояние эритроцитов и способствуют их модификации. Это выражается в нарушении физико–химических свойств мембран эритроцитов, количественном и качественном изменении мембранных липидов, увеличении пассивной проницаемости липидного бислоя для К+, Н+, Са2+. В недавних работах с помощью электронспинорезонансной спектроскопии отмечена достоверная корреляционная связь между ухудшением деформируемости эритроцитов и маркерами МС (ИМТ, АД, уровень глюкозы после перорального глюкозотолерантного теста, атерогенная дислипидемия) [3,6,10,11,13].
Деформируемость эритроцитов снижается в связи с абсорбцией на поверхности эритроцитарных мембран белков плазмы, прежде всего фибриногена. Это включает в себя изменения мембран самих эритроцитов, снижение поверхностного заряда эритроцитарной мембраны, изменение формы эритроцитов и изменения со стороны плазмы (концентрация белков, липидного спектра, уровня общего холестерина, фибриногена, гепарина). Повышенная агрегация эритроцитов приводит к нарушению транскапиллярного обмена, выбросу БАВ, стимулирует адгезию и агрегацию тромбоцитов.
Ухудшение деформируемости эритроцитов сопровождает активацию процессов ПОЛ и снижение концентрации компонентов антиоксидантной системы при различных стрессорных ситуациях или заболеваниях (в частности, при СД и ССЗ). Внутриклеточное накопление перекисей липидов, возникающих при аутоокислении полиненасыщенных жирных кислот мембран – фактор, снижающий деформируемость эритроцитов [6,9,10].
Активация свободнорадикальных процессов обусловливает нарушения гемореологических свойств, реализуемых через повреждения циркулирующих эритроцитов (окисление мембранных липидов, повышение жесткости билипидного слоя, гликозилирование и агрегация белков мембраны), оказывая опосредованное влияние на другие показатели кислородотранспортной функции крови и транспорт кислорода в ткани. Сыворотка крови с умеренно активированным ПОЛ, подтвержденным снижением уровня малонового диальдегида (МДА), приводит к увеличению деформируемости эритроцитов и снижению агрегации эритроцитов. В то же время значительная и продолжающаяся активация ПОЛ в сыворотке приводит к снижению деформируемости эритроцитов и увеличению их агрегации. Таким образом, эритроциты одними из первых реагируют на активацию ПОЛ вначале увеличением деформируемости эритроцитов, а затем, по мере накопления продуктов ПОЛ и истощения антиоксидантной защиты, увеличением жесткости мембран и агрегационной активности, что соответственно ведет к изменениям вязкости крови [2,6,13].
Кислородосвязывающие свойства крови играют важную роль в физиологических механизмах поддержания равновесия между процессами свободнорадикального окисления и антиоксидантной защиты в организме. Указанные свойства крови определяют характер и величину диффузии кислорода к тканям в зависимости от потребности в нем и эффективности его использования, вносит вклад в прооксидантно–антиоксидантное состояние, проявляя в различных ситуациях либо антиоксидантные либо прооксидантные качества [2,13].
Таким образом, деформируемость эритроцитов является не только определяющим фактором транспорта кислорода к периферическим тканям и обеспечения их потребности в нем, но и механизмом, оказывающим влияние на эффективность функционирования антиоксидантной защиты и, в конечном итоге, всей организации поддержания прооксидантно–антиоксидантного равновесия организма.
При ИР отмечено увеличение количества зритроцитов в периферической крови. При этом происходит повышенние агрегации эритроцитов за счет увеличения количества макромолекул адгезии и отмечается снижение деформируемости эритроцитов, несмотря на то, что инсулин в физиологических концентрациях значительно улучшает реологические свойства крови. При ИР, сопровождаемой повышением АД, обнаружено снижение плотности инсулиновых рецепторов и снижение активности тирозинпротеинкиназы (внутриклеточный трансмиттер инсулинового сигнала для ГЛЮТ), одновременно происходит увеличение количества Na+/Н+–каналов на мембране эритроцитов [6,14,15].
В настоящее время широкое распространение получила теория, рассматривающая мембранные нарушения, как ведущие причины органного проявления различных заболеваний, в частности, АГ при МС. Под мембранными нарушениями понимается изменение активности ионтранспортирующих систем плазматических мембран, проявляющееся в активации Na+/Н+–обмена, увеличении чувствительности К+–каналов к внутриклеточному кальцию. Основная роль в формировании мембранных нарушений отводится липидному каркасу и цитоскелету, как регуляторам структурного состояния мембраны и системам внутриклеточной сигнализации (цАМФ, полифосфоинозитиды, внутриклеточный кальций).
В основе клеточных нарушений лежит избыточная концентрация свободного (ионизированного) кальция в цитозоле (абсолютная или относительная за счет потери внутриклеточного магния – физиологичного антагониста кальция). Это приводит к усилению сократимости гладких миоцитов сосудов, инициирует синтез ДНК, увеличивая ростковые влияния на клетки с их последующей гиперплазией. Аналогичные изменения происходят и в различных типах клеток крови: эритроцитах, тромбоцитах, лимфоцитах [6,10].
Внутриклеточное перераспределение кальция в тромбоцитах и эритроцитах влечет за собой повреждение микротубол, активацию контрактильной системы, реакцию высвобождения биологически активных веществ (БАВ) из тромбоцитов, запуская их адгезию, агрегацию, локальную и системную вазоконстрикцию (тромбоксан А2).
У больных АГ изменения эластических свойств эритроцитарных мембран сопровождается снижением их поверхностного заряда с последующим образованием эритроцитарных агрегатов. Максимальная скорость спонтанной агрегации с образованием стойких эритроцитарных агрегатов отмечена у больных АГ III степени с осложненным течением заболевания. Спонтанная агрегация эритроцитов усиливает выделение внутриэритроцитарного АДФ с последующим гемолизом, что вызывает сопряженную тромбоцитарную агрегацию. Гемолиз эритроцитов в системе микроциркуляции также может быть связан с нарушением деформируемости эритроцитов, как лимитирующего фактора продолжительности их жизни.
Наиболее существенные изменения формы эритроцитов наблюдаются в микроциркуляторном русле, некоторые капилляры которого имеют диаметр менее 2 мкм. Прижизненная микроскопия показывает, что эритроциты, движущиеся в капилляре, подвергаются значительной деформации, приобретая при этом различные формы [2,3,6].
У больных АГ, сочетающейся с СД, было выявлено увеличение количества аномальных форм эритроцитов: эхиноцитов, стомацитов, сфероцитов и старых эритроцитов в сосудистом русле.
Большой вклад в гемореологию вносят лейкоциты. В связи с их низкой способностью к деформации лейкоциты могут депонироваться на уровне микроциркуляторного русла и значимо влиять на ОПСС.
Тромбоциты занимают важное место в клеточно–гуморальном взаимодействии систем гемостаза. Данные литературы свидетельствуют о нарушении функциональной активности тромбоцитов уже на ранней стадии АГ, что проявляется повышением их агрегационной активности, повышением чувствительности к индукторам агрегации.
В ряде исследований продемонстрировано наличие изменений структуры и функционального состояния тромбоцитов при артериальной гипертензии, выражающееся повышением экспрессии адгезивных гликопротеинов на поверхности тромбоцитов (GpIIb/IIIa, P–селектин), повышением плотности и чувствительности к агонистам тромбоцитарных a–2–адренорецепторов, повышением базальной и тромбин–стимулированной концентрации ионов Са2+ в тромбоцитах, повышением плазменной концентрации маркеров активации тромбоцитов (растворимый Р–селектин, b–тромбомодулин), повышением процессов свободно–радикального окисления липидов тромбоцитарных мембран [6,10].
Исследователями отмечено качественное изменение тромбоцитов у больных АГ под действием увеличения свободного кальция в плазме крови, что коррелирует с величиной систолического и диастолического АД. Электронно–микроскопическое исследование тромбоцитов больных АГ выявило наличие различных морфологических форм тромбоцитов, – результат их повышенной активации. Наиболее характерны такие изменения формы, как псевдоподиальный и гиалиновый тип. Отмечена высокая корреляционная связь между увеличением количества тромбоцитов с их измененной формой и частотой тромботических осложнений. У больных МС с АГ выявляется увеличение циркулирующих в крови тромбоцитарных агрегатов [2,6,10,13].
Дислипидемия вносит существенный вклад в функциональную гиперактивность тромбоцитов. Увеличение содержания ОХС, ЛПНП и ЛПОНП при гиперхолестеринемии вызывает патологическое усиление выделения тромбоксана А2 с повышением агрегационной активности тромбоцитов. Это связано с наличием на поверхности тромбоцитов рецепторов липопротеинов апо–В и апо–Е. С другой стороны, ЛПВП снижают продукцию тромбоксана, ингибируя агрегацию тромбоцитов, за счет связывания со специфическими рецепторами.
С целью оценки состояния гемореологии крови при МС нами было обследовано 98 пациентов с ИМТ>30 кг/м2, с НТГ и уровнем HbA1c>8%. Среди обследуемых больных было 34 женщины (34,7%) и 64 мужчины (65,3%); в целом по группе средний возраст пациентов составил 54,6±6,5 лет.
Нормативные показатели реологии крови были определены у нормотоников (20 пациентов), проходящих очередное, рутинное диспансерное обследование.
Электрофоретическую подвижность эритроцитов (ЭФПЭ) определяли на цитофотометре «Opton» в режиме: I=5 мА, V=100 B, t=25°. Передвижение эритроцитов регистрировали в фазово–контрастном микроскопе при увеличении в 800 раз. ЭФПЭ вычисляли по формуле: B=I/t•E, где I – путь эритроцитов в сетке окуляра микроскопа в одну сторону (см), t – время прохождения (сек), E – напряженность электрического поля (B/см). В каждом случае рассчитывалась скорость миграции 20–30 эритроцитов (N ЭФПЭ=1,128±0,018 мкм/cм/сек–1/B–1). Одновременно проводилось гемосканирование капиллярной крови с помощью микроскопа Nikon Eklips 80i.
Тромбоцитарный гемостаз – агрегационную активность тромбоцитов (ААТр) оценивали на лазерном агрегометре – Aggregation Analyser – Biola Ltd (Юнимед, Москва) по методу Born в модификации O’Brien. В качестве индуктора агрегации использовали АДФ (фирма “Serva”, Франция) в конечной концентрации 0,1 мкм (N ААТр = 44,2±3,6%).
Уровень общего холестерина (ОХС), холестерина липопротеидов высокой плотности (ХС ЛПВП) и триглицеридов (ТГ) определяли энзиматическим методом на автоанализаторе FM–901 (Labsystems – Финляндия) с использованием реактивов фирмы Randox (Франция).
Концентрацию холестерина липопротеидов очень низкой плотности (ХС ЛПОНП) и холестерина липопротеидов низкой плотности (ХС ЛПНП) последовательно рассчитывали по формуле Friedewald W.T. (1972):
ХС ЛПОНП = ТГ/2,2
ХС ЛПНП = ОХС – (ХС ЛПОНП + ХС ЛПВП)
Индекс атерогенности (ИА) рассчитывали по формуле А.И. Климова (1977):
ИА = (OXC – ХС ЛПВП)/ХС ЛПВП [10].
Концентрацию фибриногена в плазме крови определяли фотометрически с турбодиметрическим методом регистрации «Fibrintimer» (Германия), с помощью коммерческих наборов «Multifibrin Test–Kit» (Behring AG).
В 2005 г. Международный диабетический фонд (IDF) внес некоторые более жесткие критерии в определение нормального уровня гликемии натощак – <5,6 ммоль/л.
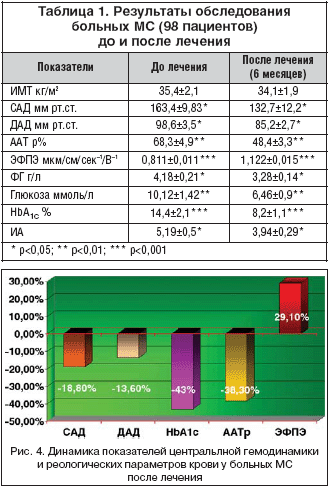
Основной целью фармакотерапии (метформин – 1 г 1–2 раза в сутки, фенофибрат – 145 мг 1–2 раза в сутки; бисопролол – 5–10 мг в сутки) исследуемой группы пациентов с МС были: нормализация гликемического и липидемического профилей крови, достижение целевого уровня АД – 130/85 мм рт.ст. Результаты обследования до и после лечении представлены в таблице 1.
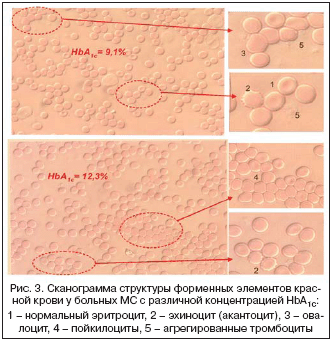
При микроскопическом исследовании цельной крови у больных МС выявляются увеличение количества циркулирующих в крови деформированных эритроцитов (эхиноциты, овалоциты, пойкилоциты, акантоциты) и эритроцитарно–тромбоцитарных агрегатов. Выраженность изменений морфологии капиллярной крови при микроскопическом гемосканировании находится в прямой пропорциональной зависимости от уровня HbA1c% (рис. 3).
Как видно из таблицы, к концу контрольного лечения отмечено статистически достоверное снижение САД и ДАД соответственно на 18,8 и 13,6% (р<0,05). В целом по группе, на фоне статистически достоверного снижения концентрации глюкозы в крови на 36,7% (p<0,01), получено значительное снижения уровня HbA1c – на 43% (p<0,001). При этом одновременно документирована выраженная статистически достоверная положительная динамика со стороны функционального состояния форменных элементов крови: скорость ЭФПЭ увеличилась на 38,3% (р<0,001), ААТр уменьшилась на 29,1% (p<0,01) (рис. 4). В целом по группе к концу лечения получена статистически достоверная динамика со стороны биохимических показателей крови: ИА уменьшился на 24,1%, концентрация ФГ снизилась на 21,5% (p<0,05).
При многофакторном анализе полученных результатов выявлена тесная статистически достоверная обратная корреляционная связь между динамикой ЭФПЭ и HbA1c – rЭФПЭ–HbA1c=–0,76; аналогичная взаимосвязь получена между функциональным состоянием эритроцитов, уровнями АД и ИА: rЭФПЭ–САД =–0,56, rЭФПЭ – ДАД = –0,78, rЭФПЭ – ИА = –0,74 (p<0,01). В свою очередь, функциональное состояние тромбоцитов (ААТр) находится в прямой корреляционной связи с уровнями АД: rААТр – САД = 0,67 и rААТр – ДАД = 0,72 (р<0,01).
АГ при МС детерминирована множеством взаимодействующих метаболических, нейрогуморальных, гемодинамических факторов и функциональным состоянием форменных элементов крови. Нормализация уровней АД, возможно, обусловлена суммарными положительными сдвигами в показателях биохимических и реологических параметров крови.
Гемодинамическую основу АГ при МС составляет нарушение соотношения между сердечным выбросом и ОПСС. Сначала возникают функциональные изменения сосудов, связанные с изменениями реологии крови, трансмурального давления и вазоконстрикторными реакциями в ответ на нейрогуморальную стимуляцию, затем формируются морфологические изменения сосудов микроциркуляции, лежащие в основе их ремоделирования. При повышении АД снижается дилатационный резерв артериол, поэтому при увеличении вязкости крови ОПСС изменяется в большей степени, чем в физиологических условиях. Если резерв дилатации сосудистого русла исчерпан, то реологические параметры приобретают особое значение, поскольку высокая вязкость крови и сниженная деформируемость эритроцитов способствуют росту ОПСС, препятствуя оптимальной доставке кислорода к тканям.
Таким образом, при МС в результате гликирования белков (в частности, эритроцитов, что документируется высоким содержанием HbA1c) имеют место нарушения реологических параметров крови: снижение эластичности и подвижности эритроцитов, повышение агрегационной активности тромбоцитов и вязкости крови за счет гипергликемии и дислипидемии. Измененные реологические свойства крови способствуют росту общего периферического сопротивления на уровне микроциркуляции и в сочетании с симпатикотонией, имеющей место при МС, лежат в основе генеза АГ. Фармакологическая (бигуаниды, фибраты, статины, селективные b–блокаторы) коррекция гликимического и липидного профилей крови способствует нормализации АД. Объективным критерием эффективности проводимой терапии при МС и СД является динамика HbA1c, снижение которого на 1% сопровождается статистически достоверным уменьшением риска развития сосудистых осложнений (ИМ, мозговой инсульт и др.) на 20% и более.
Литература
1. Балаболкин М.И. Роль ИР в патогенезе сахарного диабета 2–го типа. Тер. Архив. 2003, № 1, 72–77.
2. Зинчук В.В., Борисюк М.В. Роль кислородосвязывающих свойств крови в поддержании прооксидантно–антиоксидантного равновесия ограпнизма. Успехи физиологических наук. 199, Е 30, № 3, 38–48.
3. Катюхин Л.Н. Реологические свойства эритроцитов. Современные методы исследования. Российский физиологический журнал им. И.М. Сеченова. 1995, Т 81, № 6, 122–129.
4. Котовская Ю.В. Метаболический синдром: прогностическое значение и современные подходы к комплексной терапии. Сердце. 2005, Т 4, № 5, 236–241.
5. Мамедов М.Н., Перова Н.В., Косматова О.В и др. Перспективы коррекции проявлений метаболического синдрома влияние сочетанной гипотензивной и гиполипидемической терапии на уровень суммарного коронарного риска и тканевую инсулинорезистентность. Кардиология. 2003, Т 43, № 3,13–19.
6. Метаболический синдром. Под редакцией Г.Е. Ройтберг. Москва: «МЕДпресс–информ», 2007.
7. Сыртланова Э.Р., Гильмутдинова Л.Т. Опыт применения моксонидина у пациентов с артериальной гипертензией в сочетании с метаболическим синдромом. Кардиология. 2003, Т 43, № 3, 33–35.
8. Чазова И.Е., Мычка В.Б. Метаболический синдром, сахарный диабет 2 типа и артериальная гипертензия. Сердце: журнал для практикующих врачей. 2003, Т 2, № 3, 102–144.
9. Шевченко О.П., Праскурничий Е.А., Шевченко А.О. Артериальная гипертония и ожирение. Москва Реофарм. 2006.
10. Шилов А.М., Мельник М.В. Артериальная гипертония т реологические свойства крови. Москва: «БАРС», 2005.
11. Banerjee R., Nageshwari K., Puniyani R.R. The diagnostic relevance of red cell rigidity. Clin. Hemorheol. Microcic. 1988. Vol. 19, № 1, 21–24.
12. FIELD Study Investigators. Lancet 2005, e–publication November 14.
13. George C., Thao Chan M., Weill D. and all. De la deformabilite erytrocytairre a l,oxygenation tissulaire. Med. Actuelle. 1983, Vol. 10, №3, 100–103.
14. Resnick H.E., Jones K., Ruotolo G. and all. Insulin resistance, the metabolic syndrome, and risk of incident cardiovascular disease in nondiabetic American Indians. The Strong Heart Study. Diabetes Care. 2003. 26: 861–867.
15. Wilson P.W.F., Grandy S.M. The metabolic syndrome: practical guide to origins and treatment: part I. Circulation. 2003. 108: 1422–1425.
rmj.ru
|













 Пожилой возраст является фактором риска при раке молочной железы (РМЖ). Большая часть смертей от РМЖ происходит именно у пожилых. Не всегда у них удается провести лечение сог..
Пожилой возраст является фактором риска при раке молочной железы (РМЖ). Большая часть смертей от РМЖ происходит именно у пожилых. Не всегда у них удается провести лечение сог.. включала всех живорожденных детей, а также случаи мертворождения и прерывания беременности вследствие врожденных пороков в 7 канадских провинциях за период 1993 по 2002 гг. Основн..
включала всех живорожденных детей, а также случаи мертворождения и прерывания беременности вследствие врожденных пороков в 7 канадских провинциях за период 1993 по 2002 гг. Основн.. Роль антитромботической терапии при хронической сердечной недостаточности (ХСН) у пациентов с синусовым ритмом обсуждается много лет. В частности, оживленные дискуссии вызывает воп..
Роль антитромботической терапии при хронической сердечной недостаточности (ХСН) у пациентов с синусовым ритмом обсуждается много лет. В частности, оживленные дискуссии вызывает воп.. Жаропонижающие лекарственные средства - препараты, наиболее часто используемые для лечения детей как педиатрами, так и родителями. Этому способствуют бытующие представления об опас..
Жаропонижающие лекарственные средства - препараты, наиболее часто используемые для лечения детей как педиатрами, так и родителями. Этому способствуют бытующие представления об опас.. Неонатальный сепсис (НС) остается ведущей причиной смерти у недоношенных новорождённых. Стратегии для уменьшения частоты НС по-прежнему не достаточно эффективны, и связанная с НС с..
Неонатальный сепсис (НС) остается ведущей причиной смерти у недоношенных новорождённых. Стратегии для уменьшения частоты НС по-прежнему не достаточно эффективны, и связанная с НС с..




 Новости
Новости 