Менструальная мигрень
Мигрень является чрезвычайно гетерогенным заболеванием. Пациенты с мигренью характеризуются вариабельностью частоты, длительности и интенсивности мигренозных приступов, спектра ведущих клинических проявлений, а также наличием специфических для каждого больного провоцирующих факторов, среди которых у женщин ведущим является менструация.
Изменения гормонального статуса, связанные с менархе, беременностью, лактацией и менопаузой, часто сопровождаются изменением паттернов и частоты приступов мигрени. Роль женских половых гормонов определяет наличие строгих корреляций между частотой головной боли и менструальным циклом. Хорошо известно, что до пубертата мигрень больше распространена среди мальчиков, чем среди девочек [8]. Мигренозные атаки начинаются с менархе у одной шестой части женской популяции [4], и в конце второго десятилетия частота мигрени среди женщин превышает таковую среди мужчин [8]. Наибольшие различия распространенности мигрени среди мужчин и женщин достигаются в репродуктивном возрасте (1:2–1:3). Это касается и различной представленности двух основных форм мигрени у мужчин и женщин: так, при общем доминировании мигрени без ауры у женщин она встречается у 11% в популяции (мигрень с аурой в 5%), в мужской популяции, напротив, несколько доминирует мигрень с аурой (в 3%), а мигрень без ауры встречается с частотой 2%.
Около 60% менструирующих женщин с мигренью испытывают четкую связь между мигренью и началом менструации [7]. По отношению к таким формам мигрени, когда наблюдается четкая связь с менструальным циклом, но при этом атаки могут возникать и в другие дни менструального цикла, принято использовать термин «менструально–ассоциированная мигрень» (МАМ). В целом женщины испытывают мигренозные атаки в первые 3 дня менструации в 2,5 раза чаще, чем в другие дни менструального цикла [12]. При этом только у 7–19% женщин с мигренью приступы возникают исключительно в перименструальный период [13]. Такие формы мигрени, которые возникают исключительно в перименструальном окне и не возникают в другие периоды цикла, обозначают как «истинная менструальная мигрень» (ММ). При этом понятие «перименструальное окно» включает 2 дня до и первые 3 дня менструации (–2+3). Изменения частоты мигрени наблюдаются во время беременности и лактации [16], также как и во время менопаузы [17]. Клинические наблюдения показывают, что от 60 до 70% женщин с мигренью отмечают существенное улучшение во время беременности, особенно во втором и третьем триместре. Предполагаемый механизм этого влияния связан, по–видимому, со стабилизацией уровня эстрогенов. При этом отмечается очевидный параллелизм между нарастанием уровней эстрогенов и снижением частоты приступов мигрени с течением беременности. Так, в первом триместре 47% женщин отмечает урежение приступов, во втором – 83% и в третьем – 87%; тотальная ремиссия отмечается у 11% женщин в первом триместре, у 53% – во втором и у 79% – в третьем. Примечательно, что описанная выше динамика закономерно прослеживается при мигрени без ауры. Для мигрени с аурой характерно персистирование атак и в течение беременности. Более того, некоторые наблюдения свидетельствуют о том, что если мигрень впервые возникает у беременной женщины, то, как правило, это мигрень с аурой.
Физиология менструального цикла
и мигрень
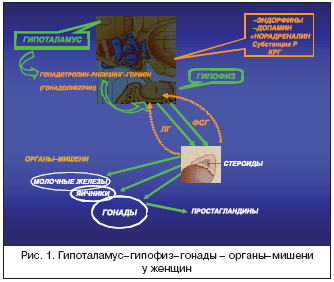
Гормональные флюктуации, ассоциированные с нормальным менструальным циклом у женщин репродуктивного возраста, регулируются активностью гипоталамо–гипофизарно–яичниковой осью [20] (рис. 1).
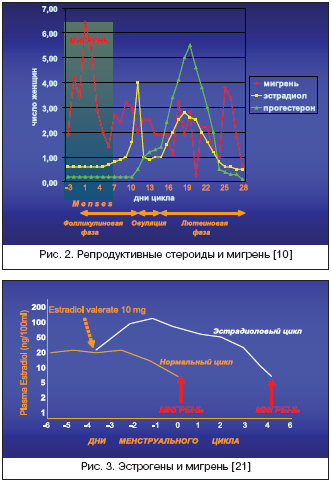
Различные нейрогормональные агенты, такие как норадреналин, серотонин, кортикотропин–рилизинг–гормон (КРГ) и опиоиды, регулируют секрецию гонадотропин–рилизинг гормона (ГнРГ) нейронами преоптического и аркуатного ядер гипоталамуса. Норадреналин проявляет стимулирующие эффекты, тогда как опиоиды, кортикостероиды и КРГ подавляют секрецию ГнРГ. В условиях, способствующих его высвобождению, ГнРГ секретируется в пульсирующем режиме в портальную систему гипофиза и регулирует тем самым секрецию гипофизарных гонадотропинов – фолликулостимулирующего и лютеинизирующего гормонов передней долей гипофиза. Последние необходимы для секреции гормонов половыми железами. Андрогены и эстрогены, в свою очередь, участвуют в секреции гонадотропинов, обеспечивая соответствующие обратные связи. В общем комплексе сложных взаимоотношений эндокринных желез и органов–мишеней в процессе менструального цикла происхождение МАМ связано, по крайней мере с двумя факторами: 1) с повышением содержания простагландинов в эндометрии и системной циркуляции в лютеиновую фазу цикла с последующим увеличением их во время менструации; 2) с резким падением (в отсутствие фертилизации) уровня эстрогена и прогестерона в позднюю лютеиновую фазу цикла. Динамика уровня репродуктивных стероидов имеет закономерную связь с частотой приступов мигрени (рис. 2).
Сопоставление профиля рекуррентных гормональных флюктуаций, которые определяют нормальный менструальный цикл, с началом менструальной мигрени отчетливо указывает, что падение уровня эстрогена в позднюю лютеиновую фазу цикла является если не причиной, то очевидным провокатором ММ. Хотя в инициации приступов ММ, по–видимому, участвует множество факторов, наиболее строгие экспериментальные доказательства существуют по отношению к снижению активности эстрогенов. Еще в начале 1970–х годов Somerwille B.W. [21,22] показана различная роль эстрогена и прогестерона в происхождении ММ. В этих классических работах продемонстрировано, что введение прогестерона в пременструальный период откладывало начало менструации у женщин с тяжелой ММ, но не влияло на время возникновения приступов мигрени. И, напротив, введение эстрогена не влияло на время возникновения менструации, но существенно откладывало возникновение мигренозного приступа (рис. 3). Эти исследования показали, что резкое падение уровня эстрогенов, предшествующее менструации, является ключевым фактором инициации приступов ММ.
Нейрогенные эффекты
репродуктивных стероидов
Закономерные флюктуации репродуктивных стероидов, происходящие в перименструальный период, являются важнейшим условием снижения порога триггирования ММ. Эти представления базируются на разносторонних исследованиях, как экспериментальных, так и клинических. В серии экспериментальных работ было показано, что высокие уровни эстрогенов коррелируют с более высокой болевой толерантностью. Так, введение 17–?–эстрадиола и прогестерона крысам женского пола после оварэктомии демонстрирует достоверное увеличение болевых порогов в ответ на электрическую стимуляцию [3]. При этом анальгетический эффект блокируется антагонистами опиоидов, что предполагает участие в этих процессах эндогенной опиоидной системы. В контексте рассмотрения ММ важными являются данные экспериментальных исследований [15], показывающих, что эстрогеновое связывание с внутриклеточными рецепторами в нейронах тригеминального ганглия регулирует экспрессию галанина и нейропептида Y, ключевых пептидов, участвующих в ноцицепции. В клинических исследованиях Cahill C.A. [1] показано, что у беременных женщин значительно выше уровни ?–эндорфина в сравнении с небеременными в середине менструального цикла.
Биологической основой взаимоотношений репродуктивных стероидов и ММ являются множественные нейрогенные эффекты, прежде всего эстрогенов. Наличие плотной сети эстрогеновых рецепторов (ER?, ER?) в церебральной коре, лимбической системе, гипоталамусе и определенных стволовых образованиях, таких как центральное серое вещество, моноаминергические ядра и тригеминальное ядро, предопределяет регулирующее влияние эстрогенов на геномные, внутриклеточные сигнальные и другие процессы нейропластичности. К настоящему времени хорошо известны стимулирующие эффекты эстрогенов на формирование факторов роста (нейротрофинов), прежде всего BDNF. Эстрадиол является важным промоутером развития нейронов и нейропиля и играет ключевую роль в развитии полового диморфизма и секс–специфичной латерализации корковых функций и стволовых асимметрий [14]. Эстрадиол оказывает модулирующее влияние на нейрональную возбудимость, меняя пластические свойства терминалей аксонов и рецепторов. В частности, введение эстрадиола экпериментальным крысам женского пола сопровождается увеличением плотности шипикового аппарата на латеральных ветвях апикальных дендритов CA1 пирамидальных клеток гиппокампа, населенных NMDA–рецепторами, что увеличивает уровень глутаматергической активности [26]. Эстрадиол обладает способностью активировать глутаматергическую трансмиссию посредством аллостерической стимуляции NMDA–рецепторов. Кроме того, эстрадиол снижает нейроингибиторное влияние ГАМК путем подавления активности глутаматдекарбоксилазы. Известны множественные эффекты влияния эстрогена в пределах серотонинергической системы: активирующее влияние на синтез серотонина и ингибирующее – на его энзиматический метаболизм. Посредством этих механизмов эстрогены участвуют в процессах нейрональной возбудимости, регуляции сосудистого тонуса, болевой трансмиссии, что может играть ключевую роль в катамениальной перименструальной экзацербации мигренозной головной боли. Эти и многие другие экспериментальные данные свидетельствуют о сложном характере мультимодальных нейрогенных влияний эстрогенов. Клинические исследования в большей части подтверждают взаимоотношения между уровнем эстрогена и изменением порога инициации мигренозных приступов. В клинических исследованиях также оценивались флюктуации болевой перцепции и порогов боли в течении менструального цикла женщин. Hellstr?m B. и Anderberg U.M. исследовали болевую перцепцию на протяжении нескольких менструальных циклов у женщин с длительно существующей хронической болью [6]. При использовании методики ежедневной регистрации показателей восприятия боли получено значительное увеличение болевой перцепции в первые 5 дней по сравнению с любыми другими днями менструального цикла. При исследовании женщин без хронической боли получены сходные данные снижения болевых порогов во время пременструальной и менструальной фазы цикла [16]. Перименструальное снижение болевых порогов также отмечается у женщин, использующих оральные контрацептивы.
Клинические характеристики
менструальной мигрени
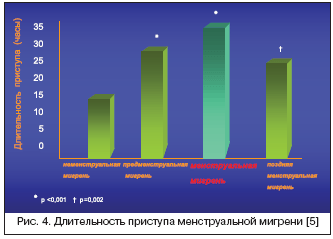
Несмотря на то, что существуют разные точки зрения относительно особенностей катамениальных мигренозных приступов, в целом создается впечатление о более тяжелом их течении по сравнению с приступами, возникающими вне «перименструального окна». Например, в исследовании Stewart W.F. с соавт. [23] менструирующих женщин с мигренью было отмечено, что приступы мигрени в целом чаще наблюдаются в период –2+2, т.е. за 2 дня до менструации и первые 2 дня менструального цикла. При этом наблюдалось лишь небольшое увеличение интенсивности боли в приступах МАМ. Напротив, исследования пациентов специализированных клиник показывают, что приступы катамениальной мигрени характеризуются большей тяжестью, длительностью и резистентностью к традиционной терапии и соответственно оказывают более дезадаптирующее влияние на пациенток, чем приступы, возникающие у тех же самых пациенток в другие дни менструального цикла. Granella F. с соавт. оценивали характеристики мигрени у 64 женщин с МАМ в течение 2 последовательных менструальных циклов [5]. Было показано, что атаки, которые возникали в менструальный период (1 и 2 день) характеризовались большей длительностью (рис. 4), большим уровнем дезадаптации и устойчивостью к терапии по сравнению с пременструальными (–1 и –2 дни) и поздними менструальными (с 3 по 7 дни) приступами.
Более дезадаптирующее влияние на пациентов мигренозных приступов, ассоциированных с менструацией, показано и в другом исследовании [2]. Приступы менструальной мигрени характеризовались большим временем нетрудоспособности и большим временем с более чем 50% снижением продуктивности по сравнению с неменструальными приступами.
Принципы ведения больных
с менструальной мигренью
Выбор терапевтической стратегии для лечения пациента с МАМ имеет некоторые особенности. Сложности ведения больных с менструально–ассоциированными приступами мигрени связаны не только с гетерогенностью тяжести, длительности приступов, возникающих в разные фазы менструального цикла. В значительной степени определенные трудности обусловлены выраженными внутрииндивидуальными различиями терапевтических ответов на традиционные средства. Клинические исследования показывают, что при МАМ приступы, возникающие в перименструальный период, труднее поддаются лечению. Это требует специального анализа клинической эффективности различных методов лечения у данной категории больных.
В построении терапевтической программы у пациенток с ММ первым этапом является корректный диагноз, который основывается прежде всего на клинических критериях (рис. 5).
Особенностью диагностики МАМ является важность ведения дневника головной боли. Главной целью заполнения дневника с фиксированием приступов головной боли и менструаций является установление связи между мигренозными приступами с соответствующими днями менструального периода. В течение трех месяцев пациентка должна заполнять в дневнике дни менструации (например, символом «0»), дни мигренозной головной боли (например, символом «Х») и дни немигренозной головной боли (например, символом «/»). Такой простой и доступный способ позволяет установить или исключить связь между мигренозными приступами и менструацией. Приведенный на рисунке 6 пример дневника головной боли показывает четкие различия между менструальной и неменструальной мигренью [11].
При выборе оптимального способа лечения как МАМ, так и мигрени в целом важнейшей характеристикой является частота головной боли. При редких приступах (менее 2 раз в месяц) купирование приступов проводится в соответствии с общими принципами лечения, для чего используются как неспецифические средства (простые и комбинированые анальгетики, нестероидные противовоспалительные средства), так и специфические антимигренозные средства – триптаны. Агонисты 5НТ?B/?D–рецепторов являются наиболее изученным классом препаратов в купировании острых приступов мигрени и ММ в том числе. Несмотря на тот факт, что в целом ММ отличается тяжестью и относительной устойчивостью к терапии, триптаны по сравнению с другими классами препаратов демонстрируют высокую эффективность в лечении приступов ММ. Эффективность лечения триптанами ММ сопоставима с эффектами купирования мигренозных приступов в целом. В специальном исследовании эффективности золмитриптана в купировании приступов МАМ проводился анализ основных показателей (процент больных с облегчением и с полным купированием боли через два часа от момента приема препарата) эффективности различных доз (от 1,25 мг до 5 мг) в зависимости от интенсивности боли у 579 больных [9]. Результаты исследования показали достоверно более высокие показатели эффективности золмитриптана по сравнению с плацебо (48% vs 27%), в частности, по характеристикам снижения боли в течение 2 часов от момента приема препарата.
При частых приступах, особенно длительных и резистентных к терапии, тем более, если приступы ММ предсказуемы и возникают в каждом менструальном цикле, таким больным может быть применена краткосрочная профилактика. Тактика краткосрочной профилактики предполагает лечение короткими курсами в определенные дни менструального цикла. С этой целью возможно использование нескольких классов лекарственных средств: препаратов магния, НПВП, трансдермальное введение эстрогена [24]. Терапия эстрогенами осуществляется строго в течение 7 дней (–2+5) и, как показывают отдельные клинические наблюдения, может способствовать снижению частоты приступов ММ. Однако опыт использования перечисленных методов ограничен из–за малого числа исследований. Наиболее изученными в доказательных исследованиях препаратами в краткосрочной профилактике ММ являются триптаны. В соответствии с применением стандартных протоколов и с анализом традиционных объективных критериев эффективности выполнено несколько плацебо–контролируемых исследований. Так, проводилось двойное слепое плацебо–контролируемое исследование эффективности золмитриптана [25] в различных дозах (2,5 мг и 5 мг) у 244 пациентов с ММ, у которых приступы возникали преимущественно в «перименструальном окне» (–2+5). Терапия золмитриптаном проводилась в течение 7 дней в трех последовательных циклах. Результаты этого исследования продемонстрировали достоверно более высокую эффективность золмитриптана в более чем 50% редукции частоты ММ в дозах 2,5 и 5 мг (у 54,7 и у 58,6% больных) по сравнению с плацебо (в 37,8% случаев).
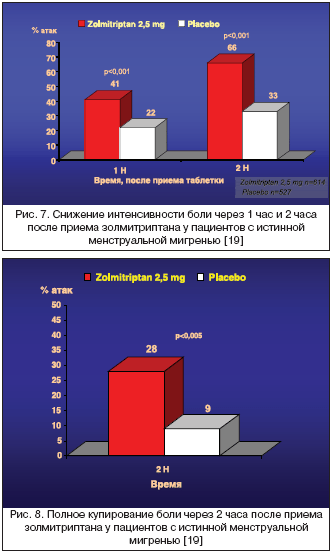
Завершено первое проспективное, мультицентровое, двойное слепое плацебо–контролируемое исследование эффективности золмитриптана в лечении острых приступов истинной ММ [19] у пациенток, у которых 90 и более процентов приступов возникали исключительно в «перименструальном окне» (–2+5). В исследование были включены 334 женщины, рандомизированные на две группы: 174 больных принимали золмитриптан 2,5 мг и 160 – плацебо. В результате в 614 мигренозных атаках был использован золмитриптан и в 527 – плацебо. Оценивалась эффективность золмитриптана в купировании атак средней и высокой интенстивности в перименструальном периоде в течение трех последовательных менструальных циклов. Золмитриптан показал достоверно более высокую по сравнению с плацебо эффективность в достижении показателя облегчения боли через 1 час (41% vs 22%) и через 2 часа (66% vs 33%) (рис. 7).
По показателю полного обезболивающего эффекта и по рецидиву возникновения головной боли золмитриптан также достоверно превосходил плацебо. Так, полное купирование боли отмечалось в 28% случаев (рис. 8), тогда как в группе плацебо этот эффект был отмечен лишь в 9% атак. Регресс головной боли лишь у 29% больных, принимавших золмитриптан, и у 45% в группе плацебо.
Таким образом, анализ всех стандартных показателей, традиционно используемых для оценки эффективности исследуемого препарата, показал превосходство золмитриптана над плацебо. Частота и профиль побочных эффектов, наблюдаемых в процессе исследования, в целом были сопоставимы с соответствующими показателями при лечении триптанами в целом. При этом наблюдался низкий процент отказа от терапии золмитриптаном (в 2% случаев), что не отличалось от аналогичного показателя в группе плацебо (в 1% случаев). Результаты исследования позволили авторам придти к заключению, что в лечении приступов истинной ММ, несмотря на ее тяжесть и относительную резистентность к терапии, золмитриптан обеспечивает высокую эффективность по основным объективным клиническим критериям эффективности и переносимости у большинства больных.

Литература
1. Cahill CA. Beta–endorfin levels during pregnancy and labor: A role in pain modulation? Nurs Res. 1989;38:200–203.
2. Dowson AJ., Kilminster SG., Salt R., Clark M., Bundy MJ. Disability associated with headaches occurring inside and outside the menstrual period in those with migraine: a general practice study. Headache. 2005;45:274–282.
3. Dowson–Basoa MB., Gintzler AR. 17–?–estradiol and progesterone modulate an intrinsic opioid analgesic system. Brain Res. 1993;601:241–245.
4. Epstein MT., Hockaday JM., Hockaday TDR. Migraine and reproductive hormones throughout the menstrual cycle. Lancet. 1975;1:543–548.
5. Granella F., Sances G., Allais G., Nappi RE., Tirelli A., Benedetto C., Brundu B., Facchinetti F., Nappi G. Characteristics of menstrual and nonmenstrual attacks in women with menstrually related migraine reffered to headache centers. Cephalalgia. 2004;24:707–716.
6. Hellstrom B., Anderberg UM. Pain perception across the menstrual cycle phases in women with chronic pain. Percept Mot Skills. 2003;96:201–211.
7. Kornstein SG., Parker AJ. Menstrual migraines: Etiology, treatment, and relashionship to premenstrual syndrome. Curr Opin Obstet Gynecol. 1977;9:154–159.
8. Lipton RB., Bigal ME. Migraine: Epidemiology, impact, and risk factors for progression. Headache. 2005;45(suppl 1):3–13.
9. Loder E., Silbersteib SD., Abu–Shakra S., Mueller L., Smith T. Efficacy and tolerability of oral zolmitriptan in menstrually associated migraine: A randomized, prospective, parallel–group, double–blind, placebo–controlled study. Headache, 2004;44:120–130.
10. MacGregor EA. «Menstrual» migraine: Towards a definition. Cephalalgia. 1996;16:11–21.
11. MacGregor A. Migraine in women. Martin Dunitz, 1999; 41.
12. MacGregor EA., Hackshaw A. Prevalence of migraine on each day of the natural menstrual cycle. Neurology. 2004;63:351–353.
13. Martin VT., Behbehani M. Ovarian hormones and migraine headache: Understanding mechanisms and pathogenesis – Part 2. Headache.2006;46:365–386.
14. McEwen BS. Invited review: Estrogens effects on the brain: multiple sites and molecular mechanisms. J Appl Physiol. 2001;91:2785–2801.
15. Puri V., Cui L., Liverman CS., Roby KF., Klein RM., Welch KM., Berman NE. Ovarian steroids regulate neuropeptides in the trigeminal ganglion. Neuropeptides. 2005;39:409–417.
16. Sances G., Granella F., Nappi RE., Fignon A., Ghiotto N., Polatti F., Nappi G. Course of migraine during pregnancy and postpartum: A prospective study. Cephalagia. 2003;23:197–205.
17. Rao SS., Ranganekar AG., Saifi AQ. Pain threshold in relation to sex hormones. Indian J Physiol Pharmacol. 1978;31:250–254.
18. Santoro N., Brown JR., Adel T., Skurnick JH. Characterization of reproductive hormonal dynamics in the peromenopause. J Clin Endocrinol Metab. 1996;81:1495–1501.
19. Sbu Shakra S, Silberstein SD, Dodick D, Freitag F, Mannix L. Oral zolmitriptan exhibits high efficacy and low recurrence rates in the acute treatment of true menstrual migraine: results of a randomized controlled trial. Headache 2003;43(5):512, Abstract OR8.
20. Silberstein S. Physiology of the menstrual cycle. Cephalalgia. 2000;20:148–154.
21. Somerwille BW. The role of progesterone in menstrual migraine. Neurology. 1971;21:853–859.
22. Somerwille BW. The role of estradiol withdrawal in the etiology of menstrual migraine. Neurology. 1972;22:355–365.
23. Stewart WF., Lipton RB., Chee E., Sawyer J., Silberstein SD. Menstrual cycle and headache in a population sample of migraineurs. Neurology. 2000;55:1517–1523.
24. Tepper S. Tailoring management strategies for the patient with menstrual migraine: focus on prevention and treatment. Headache. 2006; 46 (suppl2):61–68.
25. Tuchman M., Hee A., Emeribe U. Oral zolmitriptan 2.5 mg demonstrates high efficacy and good tolerability in the prophylactic treatment of menstrual migraine headaches. Headache. 2005;45:771–772.Abstrct OR13
26. Woolley CS., McEwen BS. Roles of estradiol and progesterone in regulation of hippocampal dendritic spine density during the estrous cycle in rat. J Comp Neurol. 1993;336:293–306.
rmj.ru
|













 Пожилой возраст является фактором риска при раке молочной железы (РМЖ). Большая часть смертей от РМЖ происходит именно у пожилых. Не всегда у них удается провести лечение сог..
Пожилой возраст является фактором риска при раке молочной железы (РМЖ). Большая часть смертей от РМЖ происходит именно у пожилых. Не всегда у них удается провести лечение сог.. включала всех живорожденных детей, а также случаи мертворождения и прерывания беременности вследствие врожденных пороков в 7 канадских провинциях за период 1993 по 2002 гг. Основн..
включала всех живорожденных детей, а также случаи мертворождения и прерывания беременности вследствие врожденных пороков в 7 канадских провинциях за период 1993 по 2002 гг. Основн.. Роль антитромботической терапии при хронической сердечной недостаточности (ХСН) у пациентов с синусовым ритмом обсуждается много лет. В частности, оживленные дискуссии вызывает воп..
Роль антитромботической терапии при хронической сердечной недостаточности (ХСН) у пациентов с синусовым ритмом обсуждается много лет. В частности, оживленные дискуссии вызывает воп.. Жаропонижающие лекарственные средства - препараты, наиболее часто используемые для лечения детей как педиатрами, так и родителями. Этому способствуют бытующие представления об опас..
Жаропонижающие лекарственные средства - препараты, наиболее часто используемые для лечения детей как педиатрами, так и родителями. Этому способствуют бытующие представления об опас.. Неонатальный сепсис (НС) остается ведущей причиной смерти у недоношенных новорождённых. Стратегии для уменьшения частоты НС по-прежнему не достаточно эффективны, и связанная с НС с..
Неонатальный сепсис (НС) остается ведущей причиной смерти у недоношенных новорождённых. Стратегии для уменьшения частоты НС по-прежнему не достаточно эффективны, и связанная с НС с..





 Новости
Новости 